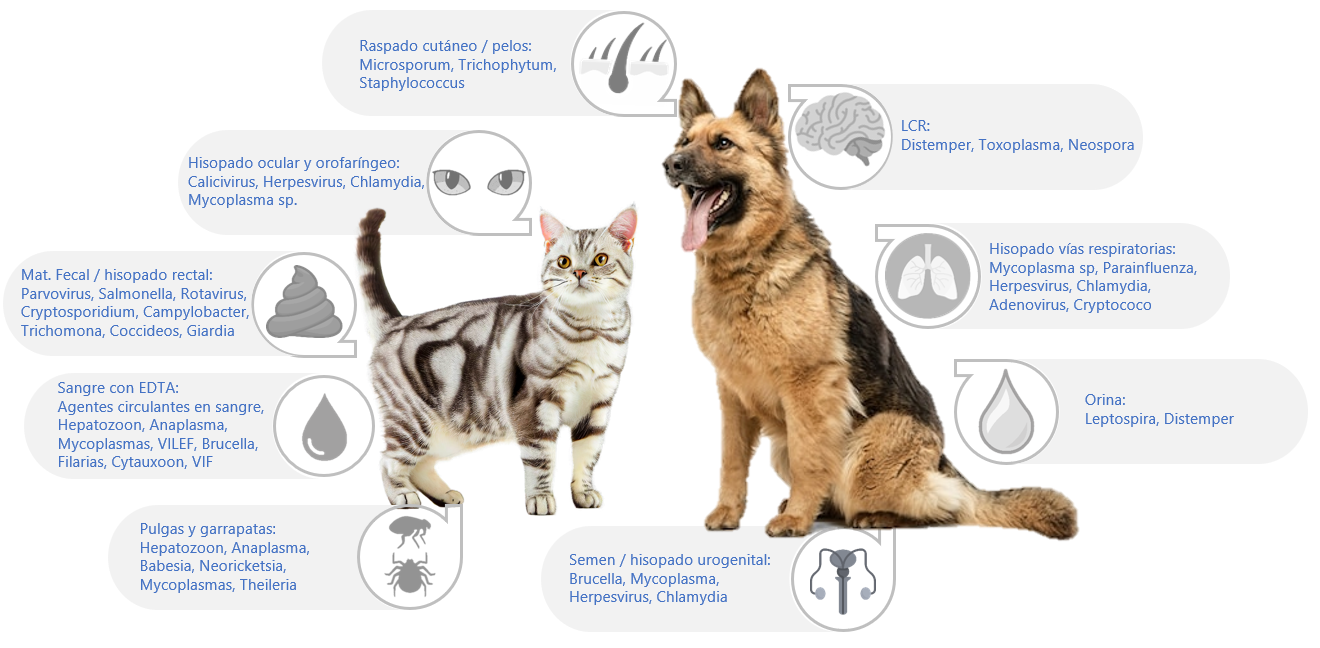
Hematología y bioquímica sanguínea
El conteo y morfología de células sanguíneas pueden variar según cada especie animal analizada. Por este motivo, la experiencia y el equipamiento deben ser adecuados para realizar los estudios de forma correcta. Otro de los aspectos importantes a tener en cuenta en veterinaria es el proceso de extracción de la sangre, debido a las diferentes anatomías que presentan los animales. En el caso de grandes animales, la extracción será más sencilla y controlada por parte del veterinario. En el caso de animales de menor porte, como por ejemplo ratones, la extracción será más delicada y fácilmente contaminada por factores externos como la piel o el pelo que pueden generar interferencias en el posterior análisis celular. El manejo del estrés en el consultorio, en el caso de animales de compañía, es muy importante debido a que en la extracción de sangre se pueden alterar ciertos parámetros como por ejemplo el conteo de plaquetas.
También es muy importante conocer los volúmenes de sangre que se pueden extraer a cada animal dependiendo de su tamaño y peso. Por norma general, el volumen total de sangre disponible dentro del cuerpo es de entre el 5% y el 8% del peso total del animal, por lo que no será lo mismo extraer sangre a un perro de 10kg que a un ratón de 20g. Por este motivo, será necesario disponer de tubos de recogida de diferentes tamaños para almacenar la sangre en óptimas condiciones en todos los casos.
Una vez obtenida la muestra, la misma se deposita en tubos los cuales contienen anticoagulantes, el mas utilizado en el EDTA (ácido etilendiaminotetraacético). Es muy importante que las proporciones entre sangre y EDTA dentro del tubo sean los indicados por el fabricante, ya que en caso contrario, la sangre, puede formar coágulos y esto conlleva un análisis incorrecto por parte de los autoanalizadores.
En hematología, el método tradicional consiste en realizar un frotis en un portaobjetos y posteriormente aplicar la técnica de tinción May-Grünwald Giemsa (MGG). El especialista será el encargado de examinar esta muestra al microscopio para determinar el tamaño, forma y número de células sanguíneas en la sangre. Es el estudio de muestras de sangre también es necesario para conocer cómo se comporta el metabolismo del paciente, en este se incluyen pruebas básicas como medición de glucosa, proteínas totales, colesterol entre otras; así como medición de analitos que nos ayudarán a determinar el funcionamiento del hígado, riñón o páncreas, todo esto siempre de la mano con una historia clínica.
El plasma es básicamente un fluido extracelular en movimiento, que transporta un gran numero de sustancias desde sitios de absorción o producción a sitios de utilización o excreción. Teniendo este concepto en cuenta, el primer factor en el que debemos pensar, debe ser si existe alguna razón para que esta sustancia esté en el plasma, es decir, si su presencia esta justificada o no. El paso siguiente es investigar de donde viene y a donde va esta sustancia, es decir, cuales son los mecanismos responsables de su incorporación y su eliminación del plasma, y el control de dichos mecanismos. A partir de aquí podemos empezar a diferenciar las causas de la existencia de concentraciones anormales de cualquiera de los componentes químicos. Las concentraciones anormalmente bajas, pueden ser debidas a, bien una incorporación al plasma disminuida o bien a un aumento en su eliminación plasmática. Al contrario, las concentraciones anormalmente altas, pueden ser debidas a un aumento de su incorporación al plasma o bien a una disminución de su eliminación plasmática.